
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
血糖监测是糖尿病管理中的重要组成部分,其结果有助于评估糖尿病患者糖代谢紊乱的程度,制定合理的降糖方案,同时反映降糖治疗的效果并指导治疗方案的调整。随着科技的进步,血糖监测技术也有了飞速的发展,使血糖监测越来越准确、全面、方便、痛苦少。目前临床上血糖监测方法包括患者利用血糖仪进行的自我血糖监测(SMBG)、连续监测3 d血糖的动态血糖监测(CGM)、反映2~3周平均血糖水平的糖化血清白蛋白(GA)和2~3个月平均血糖水平的糖化血红蛋白(HbA1c)的测定。其中患者进行SMBG是血糖监测的基本形式,HbA1c是反映长期血糖控制水平的金标准,而CGM和GA是上述监测方法的有效补充。
目前我国临床上对血糖监测的重视仍然不够,糖尿病患者仍缺乏针对血糖监测的系统的指导和教育,而部分临床医生也缺乏根据血糖监测结果规范治疗行为的指导和训练。鉴于国内现行糖尿病防治指南中对血糖监测应用的建议较为简略,我们有必要在充分参考和吸收国际经验的基础上,根据国内现有的研究数据,制定符合我国国情的血糖监测临床应用指南,以规范糖尿病诊疗行为、促进糖尿病的有效管理。
SMBG是最基本的评价血糖控制水平的手段。SMBG能反映实时血糖水平,评估餐前和餐后高血糖以及生活事件(锻炼、用餐、运动及情绪应激等)和降糖药物对血糖的影响,发现低血糖,有助于为患者制定个体化生活方式干预和优化药物干预方案,提高治疗的有效性和安全性;另一方面,SMBG作为糖尿病自我管理的一部分,可以帮助糖尿病患者更好地了解自己的疾病状态,并提供一种积极参与糖尿病管理、按需调整行为及药物干预、及时向医务工作者咨询的手段,从而提高治疗的依从性。国际糖尿病联盟(IDF)[1]、美国糖尿病学会(ADA)[2]和英国国家健康和临床医疗研究所(NICE)[3]等机构发布的指南均强调,SMBG是糖尿病综合管理和教育的组成部分,建议所有糖尿病患者都进行SMBG。在胰岛素治疗的患者中应用SMBG能改善代谢控制、并可能减少糖尿病相关终点事件,但对于非胰岛素治疗的2型糖尿病患者,SMBG在糖尿病综合管理中的地位尚未达成共识[1],需要进一步研究。
SMBG的监测频率和时间要根据患者病情的实际需要来决定。SMBG的监测可选择一天中不同的时间点,包括餐前、餐后2 h、睡前及夜间(一般为凌晨2~3时)。建议的监测频率和各时间点血糖监测的适用范围见表1,表2。
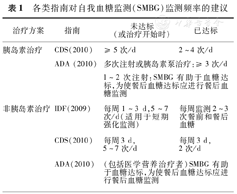
各类指南对自我血糖监测(SMBG)监测频率的建议
各类指南对自我血糖监测(SMBG)监测频率的建议
| 治疗方案 | 指南 | 未达标(或治疗开始时) | 已达标 |
|---|---|---|---|
| 胰岛素治疗 | CDS(2010) | ≥ 5次/d | 2~4次/d |
| ADA (2010) | 多次注射或胰岛素泵治疗:≥ 3次/d | ||
| 1~2次注射:SMBG有助于血糖达标,为使餐后血糖达标应进行餐后血糖监测 | |||
| 非胰岛素治疗 | IDF(2009) | 每周1~3 d,5~7次/d(适用于短期强化监测) | 每周监测2~3次餐前和餐后血糖 |
| CDS(2010) | 每周3 d,5~7次/d | 每周3 d,2次/d | |
| ADA(2010) | (包括医学营养治疗者)SMBG有助于血糖达标,为使餐后血糖达标应进行餐后血糖监测 | ||

各时间点血糖的适用范围
各时间点血糖的适用范围
| 时间 | 适用范围 |
|---|---|
| 餐前血糖 | 血糖水平很高,或有低血糖风险时(老年人、血糖控制较好者) |
| 餐后2 h血糖 | 空腹血糖已获良好控制,但HbA1c仍不能达标者;需要了解饮食和运动对血糖影响者 |
| 睡前血糖 | 注射胰岛素患者,特别是晚餐前注射胰岛素患者 |
| 夜间血糖 | 胰岛素治疗已接近达标,但空腹血糖仍高者;或疑有夜间低血糖者 |
| 其他 | 出现低血糖症状时应及时监测血糖剧烈运动前后宜监测血糖 |
目前大多数指南均推荐[1,2,3,4],胰岛素治疗的患者需要每日至少3次的SMBG,可根据不同的治疗制定个体化的监测方案,具体如下。
胰岛素强化治疗(多次胰岛素注射或胰岛素泵治疗)的患者在治疗开始阶段应每天监测血糖5~7次,建议涵盖空腹、三餐前后、睡前。如有低血糖表现需随时测血糖。如出现不可解释的空腹高血糖或夜间低血糖,应监测夜间血糖。达到治疗目标后每日监测血糖2~4次(表3)。

多次胰岛素注射治疗的血糖监测方案举例
多次胰岛素注射治疗的血糖监测方案举例
| 血糖监测 | 空腹 | 早餐后 | 午餐前 | 午餐后 | 晚餐前 | 晚餐后 | 睡前 |
|---|---|---|---|---|---|---|---|
| 未达标 | × | × | √ | × | √ | × | × |
| 已达标 | × | × | × | × |
注:"×"需测血糖的时间;"√"可以省去测血糖的时间
使用基础胰岛素的患者在血糖达标前每周监测3 d空腹血糖,每两周复诊1次,复诊前1 d加测5个时间点血糖谱;在血糖达标后每周监测3次血糖,即:空腹、早餐后和晚餐后,每月复诊1次,复诊前1 d加测5个时间点血糖谱(表4)。

基础胰岛素治疗的血糖监测方案举例
基础胰岛素治疗的血糖监测方案举例
| 血糖监测 | 空腹 | 早餐后 | 午餐前 | 午餐后 | 晚餐前 | 晚餐后 | 睡前 | |
|---|---|---|---|---|---|---|---|---|
| 未达标 | ||||||||
| 每周3 d | × | |||||||
| 复诊前1 d | × | × | × | × | × | |||
| 已达标 | ||||||||
| 每周3次 | × | × | × | |||||
| 复诊前1 d | × | × | × | × | × | |||
注:"×"需测血糖的时间
使用预混胰岛素者在血糖达标前每周监测3 d空腹血糖和3次晚餐前血糖,每两周复诊1次,复诊前1 d加测5个时间点血糖谱;在血糖达标后每周监测3次血糖,即:空腹、晚餐前和晚餐后,每月复诊1次,复诊前1 d加测5个时间点血糖谱(表5)。

每日两次预混胰岛素注射患者的血糖监测方案举例
每日两次预混胰岛素注射患者的血糖监测方案举例
| 血糖监测 | 空腹 | 早餐后 | 午餐前 | 午餐后 | 晚餐前 | 晚餐后 | 睡前 | |
|---|---|---|---|---|---|---|---|---|
| 未达标 | ||||||||
| 每周3 d | × | × | ||||||
| 复诊前1 d | × | × | × | × | × | |||
| 已达标 | ||||||||
| 每周3次 | × | × | × | |||||
| 复诊前1 d | × | × | × | × | × | |||
注:"×"需测血糖的时间
非胰岛素治疗的2型糖尿病患者,应根据治疗方案和血糖控制水平决定SMBG频率和方案,一般可每周监测3 d,在特殊情况下进行短期强化监测。
短期强化SMBG适用于:有低血糖症状;旅行;感染等应激状态;正在对用药、饮食或运动方案进行调整;HbA1c水平升高;刚进入一个新的生活环境,如入学、开始新工作或改变工作时间;需要获得更多的血糖信息等情况。监测方案为每周3 d,每天监测5~7个时间点血糖,包括餐前、餐后及睡前(表6)。在获得充分的血糖数据并采取了相应的治疗措施后,可以减少到交替SMBG方案(表7)。

非胰岛素治疗患者的短期强化血糖监测方案
非胰岛素治疗患者的短期强化血糖监测方案
| 时间 | 空腹 | 早餐后 | 午餐前 | 午餐后 | 晚餐前 | 晚餐后 | 睡前 |
|---|---|---|---|---|---|---|---|
| 周一 | |||||||
| 周二 | |||||||
| 周三 | × | × | √ | × | × | × | √ |
| 周四 | × | × | √ | × | × | × | √ |
| 周五 | × | × | √ | × | × | × | √ |
| 周六 | |||||||
| 周日 |
注:"×"需测血糖的时间;"√"可以省去测血糖的时间

非胰岛素治疗患者的交替自我血糖监测方案
非胰岛素治疗患者的交替自我血糖监测方案
| 时间 | 空腹 | 早餐后 | 午餐前 | 午餐后 | 晚餐前 | 晚餐后 | 睡前 |
|---|---|---|---|---|---|---|---|
| 周一 | × | × | |||||
| 周二 | × | × | |||||
| 周三 | × | × | |||||
| 周四 | × | × | |||||
| 周五 | × | × | |||||
| 周六 | × | × | |||||
| 周日 | × | × |
注:"×"需测血糖的时间
餐时配对方案建议每周3 d,分别配对监测早餐、午餐和晚餐前后的血糖水平(表8),帮助患者了解饮食和相关治疗措施对血糖水平的影响。

非胰岛素治疗患者的餐时配对血糖监测方案(以进餐为基础的自我血糖监测)
非胰岛素治疗患者的餐时配对血糖监测方案(以进餐为基础的自我血糖监测)
| 时间 | 空腹 | 早餐后 | 午餐前 | 午餐后 | 晚餐前 | 晚餐后 | 睡前 |
|---|---|---|---|---|---|---|---|
| 周一 | × | × | |||||
| 周二 | |||||||
| 周三 | × | × | |||||
| 周四 | |||||||
| 周五 | |||||||
| 周六 | × | × | |||||
| 周日 |
注:"×"需测血糖的时间
生活方式治疗患者建议每周测5~7点血糖谱,以指导营养和运动方案,并能在血糖持续不达标时尽早开始药物治疗。
SMBG的实施需要患者选择一款足够精准、操作简便、易学易用且有良好售后服务保障的血糖仪。血糖仪的主要功能是通过一定的化学反应将血液中的葡萄糖转化成可测量的物质,最终测量结果显示在仪器屏幕上供人们识读。目前,国内市场上的血糖仪品种繁多,按照血糖仪测量原理可以分成光化学血糖仪和电化学血糖仪,根据血糖试纸条中使用的酶又可以分为葡萄糖氧化酶和葡萄糖脱氢酶。
通常所说的血糖仪的准确性包含了两个方面:准确性和精确性。准确性是指血糖仪的测量结果与患者真实血糖值之间的一致程度,精确性是指同一样本多次重复测量后的一致程度。目前,国际上遵循的是ISO15197-2003的标准[5],国内遵循的是GB/T19634-2005的标准。
准确性的标准:在空腹状态下,采集静脉血浆用生化仪进行血糖测试的同时,采用毛细血管全血使用血糖仪进行测试,血糖仪的测试结果和生化仪的测试结果之间的偏差应控制在如下范围:当血糖浓度<4.2 mmol/L时,95%的测试结果应在±0.83 mmol/L偏差范围内;当血糖浓度≥4.2 mmol/L时,95%的测试结果应在±20%范围内。
精确性的标准:血糖浓度<5.5 mmol/L时,标准差< 0.42 mmol/L;血糖浓度≥5.5 mmol/L,变异系数(CV)< 7.5%。
国际和国内标准还要求在5~7个不同的血糖浓度条件下,评价血糖仪产品在整个测试浓度范围内的准确性和精确性。
(1)通常血糖仪采用毛细血管全血葡萄糖,而实验室检测的是静脉血清或血浆葡萄糖,采用血浆校准的血糖仪检测数值空腹时与实验室数值较接近,餐后或服糖后毛细血管葡萄糖浓度会略高于静脉血浆糖,若用全血校准的血糖仪检测数值空腹时较实验室数值低12%左右,餐后或服糖后毛细血管葡萄糖浓度与静脉血浆糖较接近。
(2)由于血糖仪采用血样大多为全血,因此红细胞压积影响较大,相同血浆糖水平时,随着红细胞压积的增加,全血葡萄糖检测值会逐步降低。若有红细胞压积校正的血糖仪可使这一差异值减到最小。
(3)目前血糖仪核心技术主要采用生物酶法,主要有葡萄糖氧化酶(GOD)和葡萄糖脱氢酶(GDH)两种,而GDH还需联用不同辅酶,分别为吡咯喹啉醌葡萄糖脱氢酶(GDH-PQQ)、黄素腺嘌呤二核苷酸葡萄糖脱氢酶(GDH-FAD)及烟酰胺腺嘌呤二核苷酸葡萄糖脱氢酶(GDH-NAD)3种。GOD血糖仪对葡萄糖特异性高,无糖类物质干扰,易受高浓度氧影响。GDH血糖仪反应无需氧的参与,无氧浓度的干扰,但因联用不同辅酶可能对非葡萄糖类物质有交叉反应。
(4)内源性和外源性药物的干扰,如对乙酰氨基酚、维生素C、水杨酸、尿酸、胆红素、甘油三酯、氧气、麦芽糖、木糖等。当血液中存在大量干扰物时,血糖值会有一定偏差。常见的可能使血糖测定值假性升高的干扰物质:非葡萄糖的其他糖类物质、维生素C、高胆红素;常见的可能使血糖测定值假性降低的干扰物质:高尿酸。
(5)pH值,温度,湿度和海拔高度都是血糖仪最佳工作状态的必要条件。
(6)操作不当,血量不足,局部挤压,更换试纸批号校正码未换或试纸保存不当等都会影响血糖监测的准确性。
SMBG的患者教育包括规范化的血糖测试和记录、SMBG结果的解读及如何通过糖尿病教育使糖尿病患者认识到,SMBG结果本身对疾病的改善作用不大,只有医护人员和患者共同回顾讨论SMBG的结果并采取措施积极改变行为和调整治疗,才能使SMBG成为有效的糖尿病自我管理的工具。
医务人员应与患者充分讨论个体化的应用SMBG结果和医护人员一起调整治疗方案。
在实际的患者自我监测过程中,使用者的操作技术也是影响血糖测量结果精准性的关键因素,可以通过以下3个步骤来规范患者的操作。
准备采血工具、血糖仪和血糖试纸,应严格按照血糖仪操作说明书的要求进行操作,并在血糖仪产品适宜的操作温度范围内进行测量;清洁采血部位(如指腹侧面),可用肥皂和温水将手(尤其是采血部位)洗干净,并用干净的餐巾纸或棉球擦干;清洁后将采血部位所在的手臂自然下垂片刻,然后按摩采血部位并使用适当的采血器获得足量的血样,切勿以挤压采血部位获得血样,否则组织间液进入会稀释血样而干扰血糖测试结果。
建议一次性吸取足量的血样量;在测试中不要按压或移动血糖试纸、血糖仪等。
记录血糖测试结果,如果测试结果可疑,则建议重新测试一次。若仍有疑问,则应咨询医护人员或与血糖仪产品厂家联系。在确定原因和咨询医护人员前,请务必不要更改当前的糖尿病治疗方案;取下测试用的血糖试纸,并与针头一起丢弃在适当的容器中;将血糖测试用品(血糖仪、血糖试纸、采血器等)存放在干燥清洁处。
质量控制:新买的血糖仪、启用新的试纸条及血糖仪更换电池后需要用随机所带的模拟液或质控液进行仪器校正,当SMBG结果与HbA1c或临床情况不符时,或怀疑血糖仪不准确时,应随时进行仪器校准。
SMBG血糖数据管理:血糖日志应包含血糖、饮食、运动等多方面信息,有条件可进行计算机化的数据管理[6],利用有线的USB或无线传输技术将血糖仪与电脑连接,借助血糖管理软件将血糖数据下载,可显示血糖记录册、血糖趋势图、14天图谱等,能更好地用以评价血糖控制趋势及药物、饮食和运动对血糖控制的影响,指导治疗方案的优化。
血糖控制目标,监测的目的,指导患者如何解释监测结果,如何参考结果采取行动。同时,医务人员应认真审查血糖记录,并根据SMBG监测结果调整治疗方案。
由于血糖仪检测技术和临床应用的限制,SMBG存在某些局限性:针刺采血可能引起患者不适感;操作不规范可能影响血糖测定结果的准确性;监测频率不足时,对平均血糖、血糖波动或低血糖发生率的判断应谨慎;而过于频繁的监测可能导致一些患者的焦虑情绪。
HbA1c是反映既往2~3月平均血糖水平的指标,在临床上已作为评估长期血糖控制状况的金标准,也是临床决定是否需要调整治疗的重要依据。无论是1型糖尿病的糖尿病控制与并发症研究(DCCT)还是2型糖尿病的英国前瞻性糖尿病研究(UKPDS)等大型临床试验,均已证实以HbA1c为目标的强化血糖控制可降低糖尿病微血管及大血管并发症的发生风险[7,8]。
根据检测原理不同,HbA1c的测定方法分为二大类,一类是根据血红蛋白(Hb)所带电荷不同来区分A0与A1c,包括离子交换色谱法、毛细管电泳法、等电聚焦法等;另一类是利用HbA1c与非HbA1c的分子结构差异来分别,多采用亲和色谱法和免疫化学方法[9]。目前最常用的是基于高效液相的检测方法,其精密度高、重复性好且操作简单,已被临床广泛采用。
自20世纪60年代后期对HbA1c进行描述以来,由于糖基化的生物化学、临床需求和管理的多样性建立了多种HbA1c的检测方法。尽管HbA1c标准化测定的问题早在1984年即已提出[9,10],但直到1993年DCCT的结果发布后,才开始受到关注。美国临床化学协会(AACC)在1993年成立分委会开展HbA1c测定的标准化工作,使不同方法的结果可溯源至DCCT的参考结果,1996年由美国国家HbA1c标准化计划(NGSP)指导委员会完成标准化工作。2000年美国90%实验室以HbA1c报告糖化血红蛋白的结果,所有参加NGSP活动实验室测定结果的室间CV小于5%,HbA1c结果与靶值的偏差小于0.8%。美国临床实验室标准委员会(NCCLS)采纳了NGSP的HbA1c测定的标准化模式。
1995年国际临床化学和实验室医学联盟(IFCC)成立了专门的工作组,目的是研发HbA1c测定的标准物质和标准方法,研究一个可供追溯的参照系统。在其建立的实验室网络中,使用纯化的HbA1c和快速血红蛋白(HbAO)进行校准,并致力于建立与NGSP结果间的联系。实验结果显示,IFCC的HbA1c结果略低于NGSP结果,但实验操作比较复杂,耗时较长,费用较高,不宜作为临床常规检查之用。
2010年5月ADA、EASD、IDF、国际儿童和青少年糖尿病协会(ISPAD)及IFCC发表了2010年全球HbA1c标准化测定共识[11]。内容包括:(1)HbA1c的检测必须在世界范围内标准化,包括参照系统和数值报告;(2)IFCC的参考系统是惟一能够满足标准化要求的方法;(3)将来HbA1c以国际统一单位IFCC单位(mmol/mol)以及衍生的NGSP单位(%)报告,使用IFCC-NGSP换算公示;(4)要确保基层糖尿病中心容易获得国际统一单位(IFCC)和NGSP单位的转换公式;(5)杂志编辑和出版物建议采用国际统一单位IFCC和NGSP/DCCT双重单位报告HbA1c;(6)以HbA1c表示糖化血红蛋白,在指南或教育材料中也可以简写为A1c;(7)共识一直到2011年有效,将在2011年IDF会议上再次讨论。
基于上述背景,我们建议:(1)目前应采用结合NGSP标准化的HbA1c结果来估计平均血糖水平;(2)实验室应该采用离子交换高效液相色谱法检测HbA1c,但需参加卫生管理部门的质控;(3)HbA1c仍然是糖尿病管理的关键指标,要尽量避免HbA1c参考范围的变化。
根据《中国2型糖尿病防治指南》的建议,在治疗之初至少每3个月检测1次,一旦达到治疗目标可每6个月检查一次。HbA1c测定应采用可溯源到DCCT曾使用的方法进行。2型糖尿病的HbA1c的控制目标详见《中国2型糖尿病防治指南》。
以往由于HbA1c的检测不够标准化,故不推荐用于诊断糖尿病。近年,HbA1c的标准化检测在全球不断完善,尤其是在2003年建立了一种新的更特异的检测参照[12],促进了对HbA1c作为糖尿病筛查和诊断方法的重新评估。
2009年由美国糖尿病学会、欧洲糖尿病学会及国际糖尿病联盟组成的国际专家委员会,在复习了来自埃及、匹马印第安、全美健康和营养调查的三项横断面流行病学资料的基础上发布了一份应用HbA1c诊断糖尿病的报告,指出采用HbA1c为6.5%识别存在进展型视网膜病变风险的患者,并由此作出糖尿病诊断时,具有足够的敏感性和特异性[13]。2010年ADA将HbA1c ≥6.5%纳入糖尿病的诊断标准[14]。2011年WHO正式发布"应用糖化血红蛋白诊断糖尿病"的咨询报告,推荐在有条件的地方将HbA1c检测作为糖尿病的辅助诊断手段,6.5%为诊断糖尿病的临界值。同时,HbA1c<6.5%并不能排除经血糖检测诊断的糖尿病患者[15]。近年国内学者也开展了相应研究,探讨在中国人群中应用HbA1c筛查及诊断糖尿病及糖尿病前期的价值[16,17,18]。因HbA1c 6.5%的切点是否适合我国人群尚未在我国人群中验证且我国HbA1c检测方法的标准化程度不够,测定的仪器和质量控制尚不能符合目前糖尿病诊断标准的要求,因此目前暂不推荐应用HbA1c诊断糖尿病。
1.无需患者空腹,可以任意时间采血,不受进餐影响。
2.较静脉血糖更能反映长期的血糖情况,且不受短期饮食、运动等生活方式变化的影响。
4.一些非血糖因素影响HbA1c而引起的误差少见,如血红蛋白病。
任何可以引起红细胞平均寿命增加的因素都会增加HbA1c的浓度且不依赖于血糖水平,如脾切除后红细胞清除率下降。
任何可能缩短红细胞寿命的因素可降低HbA1c,如溶血性贫血,因为未成熟红细胞中的血红蛋白和周围葡萄糖结合少,活动性出血会使网织红细胞的生成增加,从而减少红细胞的平均寿命;接受透析治疗尿毒症患者红细胞寿命缩短[20]。
维生素C、维生素E、大剂量的水杨酸盐、促红细胞生成素治疗者及氨苯砜可使测定结果降低[20]。
检测结果对调整治疗后的评估存在"延迟效应",不能精确反映患者低血糖的风险,也不能反映血糖波动的特征。
糖化血清蛋白(GSP)是血中葡萄糖与血浆蛋白(约70%为白蛋白)发生非酶促反应的产物。各种血清蛋白质与糖的结合过程基本相同,蛋白质分子上非离子型的ε或α-氨基与醛糖上的羧基形成不稳定加合物,即席夫碱。这是一可逆反应,席夫碱既可解离为蛋白质与醛糖,又可通过转位重排生成较稳定的酮胺。其结构类似果糖胺(FA),故将GSP测定又称为果糖胺测定。由于白蛋白在体内的半衰期较短,约17~19 d,所以GSP水平能反映糖尿病患者检测前2~3周的平均血糖水平。GSP测定方法简易、省时且不需要特殊设备,可广泛适用于基层医疗单位。但由于GSP测定是反映血浆中总的糖化血浆蛋白质,其值易受血液中蛋白浓度、胆红素、乳糜和低分子物质等的影响,尤其在低蛋白血症和白蛋白转化异常的患者[28];同时由于血清中非特异性还原物质也可发生此反应,加之不同蛋白组分的非酶糖化反应率不同,故GSP检测法特异性差,目前有逐渐被GA取代的趋势。
GA是在GSP基础上进行的定量测定,是利用血清糖化白蛋白与血清白蛋白的百分比来表示GA的水平,去除了血清白蛋白水平对检测结果的影响,因此较GSP更精确[29],近年来开始在临床逐渐得到推广应用。
GA检测方法的统一化和标准化是临床应用的关键因素。GA检测在20世纪80年代国外已有应用,最早的GA测定为日本学者研发的高压液相离子交换法(HPLC法)。HPLC法测定GA处理样本量小,代价高昂,不适宜临床常规开展而未得到广泛应用。2002年由美国研制的一种特异性较高的糖化血清白蛋白测定方法——固体酶法,但在临床应用中发现,对于输注高能量氨基酸的患者,测定结果会异常升高。
近年由日本开发研制的应用液态试剂的酶法检测GA(GA-L)是在固体酶法的基础上开发出液态试剂,减少了溶解处理,提高操作性[29]。GA-L检测具有良好的稀释直线性、日内重复性和日间稳定性,并与HPLC检测法有良好的一致性[30],因此目前临床上应用最多。2003年起国内也开展液态酶法测定GA的研究并应用于临床[31,32,33,34,35,36,37]。
2005年Yamaguchi等[38]报道了一种应用干性化学试剂的酶法测定GA的检测系统,该检测仪需血标本量小,可在5 min之内测定GA数值,与GA-L有较好相关性。
从20世纪80年代的HPLC法,21世纪初的固体酶法,至近年的液态酶法,乃至新近的干性酶法,GA检测方法逐步趋于简便、迅捷、精确和实用。并且GA-L采用酶法可在任何自动生化分析仪上进行检测,使其在临床的推广应用成为可能。
GA作为新的监测方法,由于在临床上应用的时间相对较短,目前尚缺乏公认的正常值。近年国内各地亦开展了GA正常参考值的研究,2009年上海市糖尿病研究所采用全国10个中心的临床协作研究,最终入选了380例20~69岁正常人群并初步建立中国人GA正常参考值为10.8%~17.1%[31]。同期北京地区的研究显示GA正常参考值为11.89%~16.87%[34]。
因白蛋白在体内的半衰期较短,且白蛋白与血糖的结合速度比血红蛋白快,所以GA对短期内血糖变化比HbA1c敏感,通常认为GA测定可反映患者近2~3周内的平均血糖水平,是评价患者短期糖代谢控制情况的良好指标,尤其是对于糖尿病患者治疗方案调整后疗效的评价,比如短期住院治疗的糖尿病患者[33],GA可能比HbA1c更具有临床参考价值[39,40,41]。
急性应激如外伤、感染以及急性心脑血管事件等发生时,非糖尿病个体在此时出现的高血糖,难以与糖尿病鉴别。GA和HbA1c联合测定有助于判断高血糖的持续时间,可作为既往是否患有糖尿病的辅助检测方法,从而客观评估糖代谢紊乱发生的时间及严重程度以指导诊治[42]。
上海市糖尿病研究所的研究提示,与HbA1c相似,GA同样适合于糖尿病的筛查,GA≥17.1%可以筛查出大部分未经诊断的糖尿病患者,同时检测空腹血糖和GA可以提高糖尿病筛查率[36]。GA异常是提示糖尿病高危人群需行OGTT检查的重要指征,尤其对于空腹血糖正常者意义更为明显。当然,GA能否作为糖尿病筛查指标仍需进一步的前瞻性流行病学研究。
在某些特殊人群如糖尿病终末期肾病透析患者,特别是对于进行血液透析等影响到红细胞寿命的糖尿病患者,HbA1c测定常被低估,而此时GA测定不受影响,提示对于进行血液透析等影响到红细胞寿命的糖尿病患者,GA较HbA1c更能反映血糖控制的情况[43,44]。
血白蛋白的更新速度影响GA值的水平。同样的血糖水平,血白蛋白更新速度加快的个体GA水平较低,血白蛋白更新速度降低的个体GA水平较高。因此,在评估伴有白蛋白转化异常的临床疾病如肾病综合征、甲状腺功能异常、肝硬化的糖尿病患者的GA水平时需考虑到这一因素。
甲状腺激素能够促进白蛋白的分解,从而也会影响血清GA的水平,GA与促甲状腺激素(TSH)成正相关,与游离甲状腺素3(FT3)及游离甲状腺素4(FT4)成负相关。因此甲状腺功能亢进症可使测定结果降低,甲状腺功能减低症可使测定结果升高。
相对于HbA1c来说,GA反映血糖控制水平的时间较短,且目前尚缺乏有关GA与糖尿病慢性并发症的大样本、前瞻性研究,因此临床上对于长期血糖控制水平的监测,GA的使用应该谨慎。
CGM是指通过葡萄糖感应器监测皮下组织间液的葡萄糖浓度而反映血糖水平的监测技术,可以提供连续、全面、可靠的全天血糖信息,了解血糖波动的趋势,发现不易被传统监测方法所探测的高血糖和低血糖。因此,CGM可成为传统血糖监测方法的一种有效补充。有关CGM技术的临床优势、适应证、监测数据的准确性评判、监测结果的阐释及如何指导临床实践等内容详见2009年《中国动态血糖监测临床应用指南》[47],其中应特别注意以下几点[48]。
CGM的仪器有2种,分别是回顾式CGM和实时CGM,目前我国临床上应用的主要为回顾式CGM。作为一种新型的血糖监测技术,CGM检查的费用还较为昂贵,因此在临床应用过程中,要掌握好监测的适应证和时机,并充分利用其优势,从而最大化地发挥它的临床价值。CGM主要的优势在于能发现不易被传统监测方法所探测到的高血糖和低血糖,尤其是餐后高血糖和夜间的无症状性低血糖。例如:(1)可以发现与下列因素有关的血糖变化,如食物种类、运动类型、药物品种、精神因素、生活方式等;(2)了解传统血糖监测方法难以发现的餐后高血糖、夜间低血糖、黎明现象、Somogyi现象等;(3)帮助制定个体化的治疗方案;(4)提高治疗依从性;(5)提供一种用于糖尿病教育的可视化手段。而在评估血糖波动及发现低血糖方面CGM具有独特的优势。
因此,CGM主要适用于以下患者或情况,包括:(1)1型糖尿病;(2)需要胰岛素强化治疗(例如:每日3次以上皮下胰岛素注射治疗或胰岛素泵强化治疗)的2型糖尿病患者;(3)在SMBG指导下使用降糖治疗的2型糖尿病患者,仍出现无法解释的严重低血糖或反复低血糖,无症状性低血糖、夜间低血糖,无法解释的高血糖,特别是空腹高血糖、血糖波动大,出于对低血糖的恐惧,刻意保持高血糖状态的患者,SMBG结果良好但HbA1c始终不达标者;(4)妊娠期糖尿病或糖尿病合并妊娠;(5)患者教育:进行CGM可以促使患者选择健康的生活方式,提高患者依从性,促进医患双方更有效的沟通;(6)其他糖尿病患者如病情需要也可进行CGM,以了解其血糖谱的特点及变化规律;(7)其他伴有血糖变化的内分泌代谢疾病,如胰岛素瘤等,也可应用CGM了解血糖变化的特征。其中1型糖尿病、胰岛素强化治疗的2型糖尿病以及血糖波动大的患者是首选推荐进行CGM的人群。
由于CGM技术测定的是皮下组织间液的葡萄糖浓度,而非血浆或血清中的葡萄糖浓度,因此在监测结束后进行CGM数据分析之前,很重要的一步是首先对监测结果进行准确度评判,只有监测数据被确认有效,才能用来指导治疗方案。其中动态血糖监测系统(CGMS)的"最佳准确度"评价标准为:(1)每日匹配的探头测定值和指尖血糖值≥3个;(2)每日匹配的探头测定值和指尖血糖值相关系数≥0.79;(3)指尖血糖最大值与最小值之间的差值≥5.6 mmol/L时,平均绝对差(MAD)≤28%;指尖血糖最大值与最小值之间的差值<5.6 mmol/L时, MAD≤18%。
目前有许多动态血糖的相关指标可供选用,但无论是何种指标,其原理均为经过对血糖值进行统计学转换及计算而得出,主要区别在于反映血糖水平、血糖波动及低血糖风险等方面的侧重点有所差异。临床应用中应根据不同的评估目的进行针对性的选择。对于动态血糖的正常值,目前国际上尚缺乏公认的标准。较可靠的动态血糖正常值范围应根据长期前瞻性的随访结果以及大样本的自然人群调查来决定。在取得上述研究结果之前,可依据正常人群监测结果暂定动态血糖的正常参考值。根据国内开展的一项全国多中心研究结果,推荐24 h平均血糖值<6.6 mmol/L,24 h血糖≥ 7.8 mmol/L及≤ 3.9 mmol/L的时间百分率分别<17%(4 h)、12%(3 h);平均血糖波动幅度(MAGE)及血糖标准差(SDBG)分别<3.9 mmol/L、1.4 mmol/L作为中国人动态血糖正常参考值标准。
第一,在解读结果时应着重分析血糖的波动规律和趋势,并尽量查找造成血糖异常波动的可能原因,而不是"纠结"于个别时间点的绝对血糖值。第二,每次的监测数据仅仅是反映既往短时间(如72 h)血糖控制情况,不能将此时间窗扩大化。第三,推荐采用"三步法"标准分析模式解读动态血糖图谱及数据,简要而言,即第一步分析夜间血糖,第二步看餐前血糖,第三步看餐后血糖,每个步骤先观察低血糖、后看高血糖并找到具体的原因以指导调整治疗方案。
指南执笔专家:贾伟平、李红
专家委员会成员(按姓氏拼音排列):包玉倩(上海交通大学附属第六人民医院);陈丽(山东大学齐鲁医院);葛家璞(新疆自治区人民医院);郭晓蕙(北京大学第一医院);纪立农(北京大学人民医院);姬秋和(第四军医大学西京医院);贾伟平(上海交通大学附属第六人民医院);胡仁明(复旦大学附属华山医院);李红(浙江大学医学院附属邵逸夫医院);李启富(重庆医科大学附属第一医院);李延兵(中山大学附属第一医院);刘建英(南昌大学第一附属医院);柳洁(山西省人民医院);刘静(甘肃省人民医院);陆菊明(解放军总医院);单忠艳(中国医科大学附属第一医院);石勇铨(第二军医大学附属长征医院);孙子林(东南大学附属中大医院);田浩明(四川大学华西医院);王煜非(上海交通大学附属第一人民医院);翁建平(中山大学附属第三医院);徐焱成(武汉大学中南医院);姚孝礼(西安交通大学医学院第一附属医院);杨立勇(福建医科大学附属第一医院);杨文英(中日友好医院);杨玉芝(黑龙江省医院);于德民(天津医科大学代谢病医院);赵志刚(河南省人民医院);周健(上海交通大学附属第六人民医院);周智广(中南大学湘雅二医院);朱大龙(南京大学医学院附属鼓楼医院);邹大进(第二军医大学附属长海医院)

























